El enorme avance de la investigación biotecnológica en los últimos años ha favorecido el desarrollo de técnicas que permiten introducir, eliminar o modificar de forma específica un gen, o determinados tipos de genes, en el genoma de un organismo para producir seres vivos (animales, plantas y microorganismos) con nuevas y mejores características. Este tipo de técnicas, se encuadran dentro de lo que se denomina Ingeniería Genética y los seres vivos que así se obtienen son los llamados Organismos Modificados Genéticamente.
Ratones Transgénicos
La transgénesis es un procedimiento biotecnológico por el que se introduce un gen foráneo (transgén) en el genoma de un ser vivo. En la transgénesis se busca que el transgén se integre en la línea germinal (gametos) de una manera estable, asegurando así que ese nuevo gen incorporado pueda ser heredado por la descendencia.
Los ratones fueron los primeros animales en los que se consiguió la transgénesis. En 1981, Gordon y Ruddle demostraron la integración y transmisión estables (a través de la línea germinal) de genes inyectados en pronúcleos de cigotos de ratón obtenidos por fecundación «in vitro». En 1982, Palmiter y col. obtuvieron ratones transgénicos gigantes al inyectar en el pronúcleo de un cigoto de ratón el gen de la rata que codifica la hormona del crecimiento. Estos mismos investigadores, obtuvieron también ratones transgénicos gigantes cuando el transgén introducido, que codificaba la hormona del crecimiento, era de origen humano.
Un transgén es una construcción de ADN que contiene: una secuencia que codifica una proteína específica que es la que aporta la mejora genética deseada (exón); una región que confiere a esta secuencia la capacidad de expresarse (promotor); y una serie de secuencias aisladoras y reguladoras que protegen y modulan la expresión del gen introducido.
Para conseguir una buena expresión del gen de interés, es necesario incluir todas las secuencias que modulan su expresión, de manera que se necesita un vector que admita grandes transgenes. Para ello, se han desarrollado los transgenes genómicos, basados en cromosomas artificiales de levaduras y bacterias, que son capaces de transportar grandes fragmentos de DNA en los que se pueden incluir todos los elementos reguladores del gen. Estos transgenes son los YACs y los BACs (cromosomas artificiales de levaduras y cromosomas artificiales de bacterias, respectivamente)
Las técnicas utilizadas para la producción de animales transgénicos son las siguientes:
- Microinyección pronuclear de transgenes en pronúcleos de óvulos fertilizados (cigotos).
- Vectores virales, que transfectan las células integrando en ellas su genoma previamente modificado (virus recombinantes).
- Transferencia de DNA exógeno mediada por esperma durante la fertilización (SMGT, «spermmediated gene transfer«).
- Inyección, en la cavidad de blastocistos, de células madre embrionarias (ES «cells», «embrionic stem cells») y/o células germinales embrionarias (EG, embrionic germ cells»), previamente modificadas genéticamente mediante la técnica de «gene targeting».
- Transferencia nuclear (NT, «nuclear transfer») con células somáticas, ES o EG que previamente han sido modificadas genéticamente.
En Argentina, el grupo de científicos del Instituto de Investigaciones en Ingeniería Genética y Biología Molecular (INGEBI), que depende del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) de la Facultad de Ciencias Exactas y Naturales de la Universidad de Buenos Aires (UBA), desarrolló un tipo de ratón transgénico, bautizado Th-Cre. El Th-Cre tiene sus sistemas cerebrales alterados de tal forma que imita patologías neurológicas y psiquiátricas como el mal de Parkinson, el déficit de atención con hiperactividad (ADHE, por sus siglas en inglés) y la esquizofrenia.
Ratones Knockout y Knockin
La mayoría de las técnicas utilizadas para la introducción de ADN exógeno en células producen una integración aleatoria en el genoma celular del ADN introducido. La técnica de «gene targeting» genera una modificación genética dirigida, específica y controlada, basada en la introducción o en la eliminación de ADN en lugares precisos del genoma, utilizando la recombinación homóloga de esas secuencias de ADN foráneas con los genes autóctonos.
Esta técnica requiere la utilización de células madre embrionarias (ES «cells», «embrionic stem cells»), que son pluripotentes y que, una vez modificadas genéticamente, son inyectadas en blastocistos para generar individuos mosaico o quimeras, es decir que contiene poblaciones celulares que proceden de individuos genéticamente distintos, bien sean de la misma especie o de otra diferente.
Los tipos de modificaciones genéticas que se pueden obtener por «gene targeting» son:
- «Knockouts» o inactivación génica: se bloquea la expresión de un gen concreto (eliminando un fragmento del mismo o introduciendo una mutación en su secuencia que impida su traducción), produciendo una inactivación génica y generando un animal knockout. Este animal permite estudiar qué ocurre cuando se elimina un gen concreto y, así, conocer su función.
- «Knockins«: si se introduce una mutación en un gen o se sustituye un gen por otro.
En ocasiones, la modificación genética que se introduce puede causar la letalidad del embrión. Para evitarlo, se puede controlar la expresión de la modificación genética introducida en lugar y tiempo:
- «Knockouts» o «knockins» específicos de tejido. En ellos la modificación sólo se expresa en los tejidos de interés, utilizando promotores específicos de tejido (por ejemplo que el gen se exprese en hígado y no en adipocitos).
- «Knockouts» o «knockins» condicionales o inducibles. En ellos se controla el momento de la expresión de la modificación genética. Por ejemplo, una vez que el animal ya haya nacido, con lo que se evita la posible muerte embrionaria.
El ratón es el organismo modelo más próximo a los seres humanos en los que esta técnica se puede realizar con facilidad, especialmente cuando se plantean cuestiones genéticas relacionadas con la fisiología humana. la aplicación de esta técnica en ratas es mucho más difícil y solo se ha logrado después de 2003.
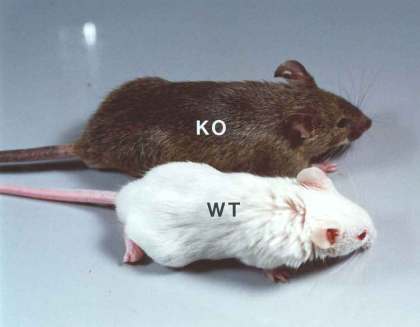
El ratón knockout p27 (agutí) es más grande que el ratón control (blanco) porque el tamaño de su esqueleto está aumentado
Los científicos Mario R. Capecchi [EE UU], Martin J. Evans [Reino Unido] y Oliver Smithies [EE UU] han recibido el Premio Nobel de Fisiología o Medicina por el descubrimiento del procedimiento para generar estirpes de ratones en las que un determinado gen es modificado gracias al uso de células madre embrionarias.
En la actualidad, se dispone de versiones de ratones knockout de unos 10.000 genes, de las que unas 500 constituyen modelos animales de enfermedades humanas.